Cloruro di metilmagnesio
Il cloruro di metilmagnesio è il composto organometallico con formula CH3MgCl. È il più semplice tra i reattivi di Grignard. In condizioni normali è un solido incolore, insolubile in etere di petrolio e benzene,[2] disponibile in commercio come soluzione in tetraidrofurano.[1] In chimica organica viene utilizzato come sintone del carbanione metilico, in maniera analoga al metillitio.
| Cloruro di metilmagnesio | |
|---|---|
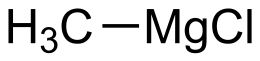 | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH3ClMg |
| Massa molecolare (u) | 74,79 |
| Aspetto | solido incolore liquido grigio in soluzione[1] |
| Numero CAS | |
| Numero EINECS | 211-629-7 |
| PubChem | 12670 |
| SMILES | C[Mg+].[Cl-] |
| Indicazioni di sicurezza | |
| Punto di fiamma | -17,2 °C |
| Temperatura di autoignizione | 320,6 °C |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 225 - 260 - 302 - 314 - 335 - 336 - 351 - EUH014 - EUH019 [1] |
| Consigli P | 210 - 231+232 - 280 - 303+361+353 - 304+340+310 - 305+351+338 [1] |
Sintesi
modificaIl cloruro di metilmagnesio si prepara facendo reagire clorometano con magnesio in tetraidrofurano. La soluzione così ottenuta viene usata direttamente come reattivo di Grignard, senza bisogno di isolare il composto.[3] Analoga reazione si può condurre anche in etere.[4]
Proprietà
modificaIl cloruro di metilmagnesio è stabile in soluzione di tetraidrofurano. È un tipico reattivo di Grignard, meno usato dei corrispondenti bromuro e ioduro, ma di costo inferiore.[3] In solventi di tipo etere è solvatato: due atomi di ossigeno del solvente si coordinano all'atomo di magnesio che diventa tetracoordinato con geometria tetraedrica.
Il cloruro di metilmagnesio reagisce con l'acqua e altri reagenti protici per formare metano:
Note
modificaBibliografia
modifica- (EN) F. Bickelhaupt e O. S. Akkerman, Magnesium Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a15_595.
- (EN) E. R. Coburn, 3-Penten-2-ol, in Org. Synth., vol. 27, 1947, pp. 65, DOI:10.15227/orgsyn.027.0065.
- (EN) W. M. Haynes (a cura di), CRC Handbook of Chemistry and Physics, 96ª ed., Boca Raton, CRC Press, 2015, ISBN 978-1-4822-6097-7.
- Sigma-Aldrich, Scheda di dati di sicurezza di Cloruro di metilmagnesio, Soluzione, su sigmaaldrich.com, 2021. URL consultato l'11 aprile 2022.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su Cloruro di metilmagnesio