Naftomicina A
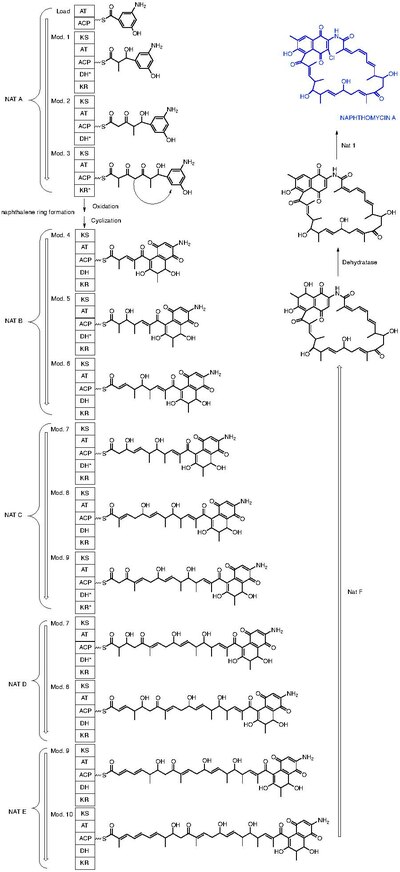
La naftomicina A è una molecola isolata sotto forma di pigmento giallo da Streptomyces collinus e mostra attività antibatteriche, antimicotiche e antitumorali.[1] Le naftomicine rappresentano la famiglia di molecole con la catena di carbonio ansa-alifatica più lunga tra le ansamicine.[2] Le origini biosintetiche dello scheletro carbonioso sono state studiate sfruttando l'enzima polichetide sintasi (PKS1) attraverso l'uso di precursori marcati con 13C e successiva analisi del prodotto tramite 13C-NMR.
| Naftomicina A | |
|---|---|
 | |
| Nome IUPAC | |
| (7E,9S,10S,11S,12E,14S,16E,20S,21S,22E,24Z,26Z)-31-cloro-4,10,14,20-tetraidrossi-3,7,9,11,17,21,27-eptametil-29-azatriciclo[28.3.1.05,33]tetratriaconta-1(33),2,4,7,12,16,22,24,26,30-decaene-6,18,28,32,34-pentone | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C40H46ClNO9 |
| Massa molecolare (u) | 720.2 g/mol |
| PubChem | 10101379 |
| SMILES | CC1=CCC(O)C=CC(C)C(O)C(C)C=C(C)C(=O)c2c(O)c(C)cc3c2C(=O)C(Cl)=C(NC(=O)C(C)=CC=CC=CC(C)C(O)CC1=O)C3=O |
| Indicazioni di sicurezza | |
Al momento, ben trentadue geni per la biosintesi della naftomicina sono stati identificati all'interno di un cluster di 106 kb.[3] Per confermare il suo coinvolgimento nella via biosintetica, è stato clonato e sequenziato attraverso la delezione di una regione di 7.2 kb.[4]
Note
modifica- ^ Q. Kang, Y. Shenb e L. Bai, Biosynthesis of 3,5-AHBA-derived natural products, in Nat. Prod. Rep., vol. 29, n. 2, 2012, pp. 243-263, DOI:10.1039/c2np00019a, PMID 22193711.
- ^ M. Balerna, W. Keller-Schierlein e C. Martius, Stoffwechselprodukte von Mikroorganismen, in Arch. Microbiol., vol. 65, n. 4, 1969, pp. 303-317, DOI:10.1007/BF00412210, PMID 4988744.
- ^ P.R. August, L. Tang e Y.J. Yoon, Biosynthesis of the ansamycin antibiotic rifamycin: Deductions from the molecular analysis of the rif biosynthetic gene cluster of Amycolatopsis mediterranei S699, in Chem. Biol., vol. 5, n. 2, 1998, pp. 69-79, DOI:10.1016/S1074-5521(98)90141-7, PMID 9512878.
- ^ L. Bai, Y. Wu e Q. Kang, Patent, CN: 2012-10300294, 2012, p. 225.
- ^ Q Kang, Y. Shenb e L. Bai, Biosynthesis of 3,5-AHBA-derived natural products, in Nat. Prod. Rep., vol. 29, n. 2, 2012, pp. 243-263, DOI:10.1039/c2np00019a, PMID 22193711.